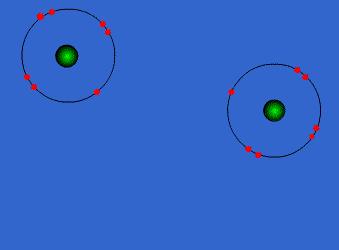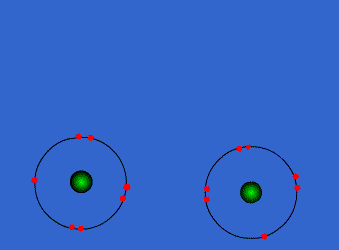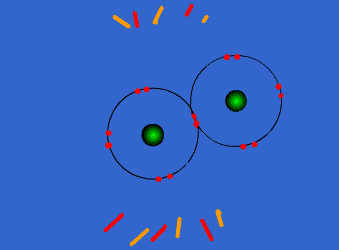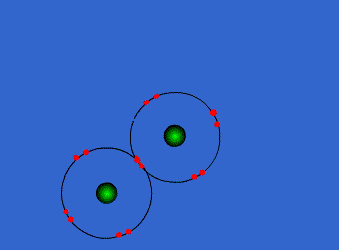
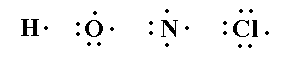| ثانوية هواري بومدين - برهوم |
السلام عليكم و رحمة الله تعالى و بركاته عزيزي الزائر / عزيزتي الزائرة يرجي التشرف بتسجيل الدخول اذا كنت عضو معنا أو التسجيل إن لم تكن عضو و ترغب في الانضمام إلي أسرة منتدى ثانوية هواري بومدين ببرهوم والاستفادة من ميزات الموقع سنتشرف بتسجيلك...شكرا ادارة المنتدى الأستاذ:سي عبد الله مسعود |

 >
>